近年、RTSM(Randomization and Trial Supply Management)が臨床試験の実施において重要な役割を果たしていることが広く認識されています。RTSMは、被験者の無作為化と治験薬のサプライチェーンを管理するために設計された包括的なシステムで、これにより、被験者の無作為割り付けや治験薬情報の管理、治験薬の再配送や在庫状況の可視化などの管理を効果的にすることが可能となります。今回はRTSMにフォーカスし、全シリーズ5回に分けてRTSMの基本的な概念から具体的な利点、今後の展望までを詳しく探っていきます。
シリーズ:RTSM(Randomization and Trial Supply Management)を探る – 臨床試験のデジタルフォーメーション
第1回 今更ですが知っていますか?IVRS、IWRS、IRTとRTSMの違い
第2回 改めて考えてみるITシステムの観点から見たTrial Supplyの重要性
第4回 RTSMのデータ連携 with EDC:構築期間をなぜ短縮できるのか?QbD (Quality by Design) をどう実現できるのか?
第5回 RTSMのデータ連携 with CTMS:QbD (Quality by Design) をどう実現できるのか?
第4回 RTSMのデータ連携 with EDC:構築期間をなぜ短縮できるのか?QbD (Quality by Design) をどう実現できるのか?
今回はRTSM (Randomization and Trial Supply Management system)と他のシステム、特にEDC (Electric Data Capture system)との連携について考えてみたいと思います。
RTSMとEDCを連携していない場合の臨床試験の運用は一般的に以下のようになります(下図参照)。
- 治験実施医療機関はRTSMに症例の同意日や背景情報、選択除外基準に関する情報を入力して無作為化を行い、Randomization Numberを入手すると同時に1ビジット目のKit Numberを入手します。
- 治験実施医療機関はEDC上にもRTSMに入力したのと同じ情報(同意日・背景情報・選択除外基準)を入力します。Randomization NumberもEDC上に入力します。
- モニターはRTSM上に記載された情報とEDC上のデータに齟齬がないかをSDVで確認します。
- データマネジメント担当者はRTSMとEDCでデータに齟齬がないかデータベース固定前にデータをダウンロードしてReconciliationを行います。
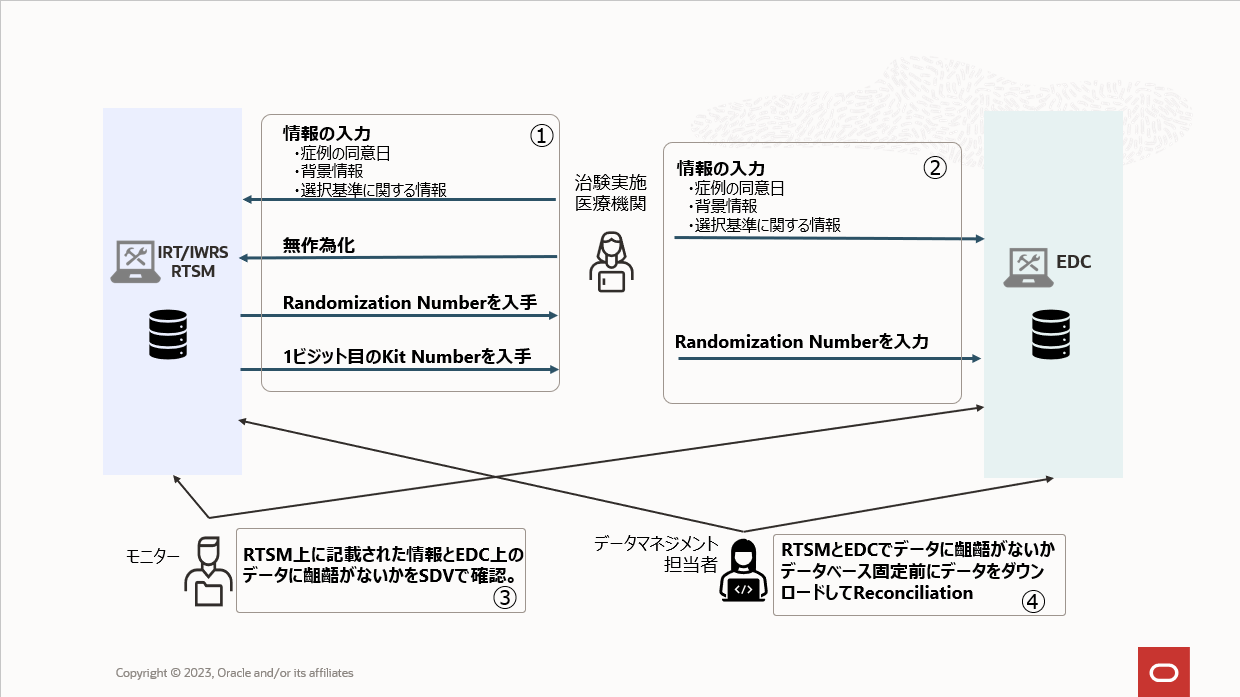
ステップ①とステップ②でデータ入力が重複し、各システムで同様のデータを扱うためその確認作業が発生しています。これらの問題はRTSMとEDCをデータ連携することで解決することが可能です。ステップ①はこれまで通りですが、ステップ②は自動的に連携されるので、データ入力は不要になります。ステップ③、ステップ④もシステム上でデータが完全に連携されているため齟齬がないかのチェックも不要になります。
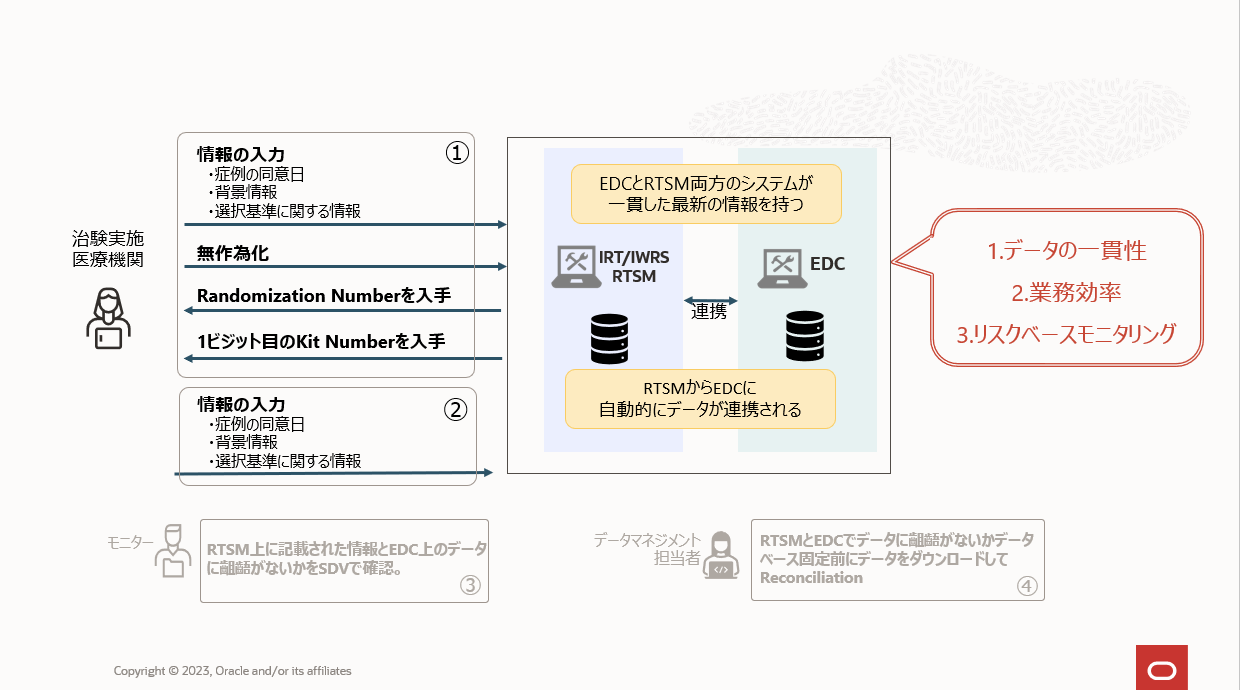
RTSMとEDCのデータ連携を行うことのメリットは以下の通りです。
- データの一貫性:手動でのデータ入力やエラーを減少させ、EDCとRTSM両方のシステムが一貫した最新の情報を持っていることを保証し間違いが起きにくい仕組み(QbD: Quality by Design)を実現することが可能になります。
- 業務効率:RTSMからEDCに自動的にデータが連携されることにより、症例が登録されたことがEDC上でリアルタイムで把握できるようになります。
- リスクベースモニタリング:EDCに一切データが入力されていない場合、その症例がいるかいないかわからないのでアラートをあげることがかなり困難になります。EDC上に強制的に症例を立ち上げることにより「症例としては存在するがCRFの入力が行われていない症例」をあぶり出しやすくすることが可能になります
一方、RTSMとEDCのデータ連携には乗り越えなければならない課題もあります。
- 技術面:RTSMとEDCの両方がデータ連携できるインターフェースを持つ必要があります。
- 連携テスト:RTSMとEDC間で正しくデータ連携が構築できたか入念なテストを行う必要があります
- 期間・費用:データ連携にかかる期間・費用を見込む必要があります
- プロジェクトマネジメントの観点:データマネジメント部門はこれまでより早めにEDCの準備を開始する必要があります。通常、EDCはFPI (First Patient In)までに用意しておくべきものですが、多少遅れても実際の臨床試験の進捗には影響がありませんでした。しかし、RTSMとEDCのデータ連携を行う場合、RTSMとEDCの両方のセットアップを完了させた上で連携テストを行う必要があり、全ての作業をFPIより前に完了させる必要があります(RTSMがFPIより前にセットアップできていないと治験薬が交付できません)。これまでの試験とタイムラインが変わるので社内のスケジュール調整などを行っておく必要がでてきます。
RTSMとEDCのデータ連携をうまく運用するためには以下の方法が考えられます。
- RTSM/EDCそれぞれの構築期間を今より短縮する。RTSMとEDCのデータ連携を行う場合、これまでの臨床試験と比較して試験のセットアップのタイムラインがよりタイトになります(EDCを連携テスト前までにセットアップしておかなければならない、連携テストを行う期間を考慮する必要がある)。RTSMの構築期間を短縮するにはカスタマイズRTSMからConfigurableなRTSMにする*1、EDCのセットアップ期間を短縮させるにはアジャイル開発ができるEDCを採用するなどが考えられます。
- オープンなデータ連携インターフェースを持ったEDC、RTSMを選定する。RTSMとデータ連携できることの重要性はSCDM (Society for Clinical Data Management ) のGCDMP (Good Clinical Data Management Practice)でも記載され、EDCシステムを選定する際の重要なポイントになっています*2。
- RTSMとEDCが一体化した統合型システム*3を活用することで構築期間を短縮する。最近ではRTSMとEDCが一体化した統合型システムが登場しています。そういったシステムを利用することでRTSMとEDCのデータ連携のプロセス自体を省き構築の効率アップを図ることができます。
次回はRTSMとEDC以外の他のシステムとのデータ連携について考えてみたいと思います。
参考資料・参照
*1 市場の成熟はコンフィギュラブルなRTSMの提供への移行を意味するのでしょうか? (oracle.com)
*2 https://www.jscdm.org/article/id/29/
*3 RTSMとEDCが一体化した統合型システム: Clinical One | オラクル | Oracle 日本
Clinical One RTSM: Health Sciences Clinical One RTSM | オラクル | Oracle 日本
Clinical One Data Collection (EDC): Health Sciences Clinical One Data Collection | オラクル | Oracle 日本
