2024年1月にArgus 8.4.2をリリースしました。Argusは製薬メーカー、医療機器メーカー、CROで幅広く利用されている安全性管理データベースです。
このブログではArgus 8.4.2で新たに搭載した機能を紹介します。
≪規制要件関連≫
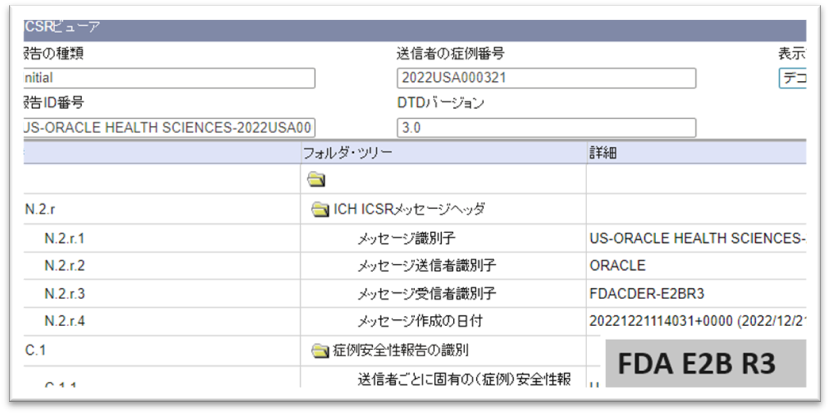
・FDA E2B R3 (治験/市販後*) 対応
Argusはいち早くFDA E2B R3に対応しました。
FDA E2B R3用Profile、および、ACK Profileを用意し、FDAへの伝送、ACK取込みが可能です。
FDAは今年1月より市販後ではE2B R3の受付を開始しています。治験のE2B R3受付はまもなく始まる予定です。E2B R3が必須となる時期についても今後発表される予定です。
(参照:FDA Adverse Event Reporting System (FAERS) Electronic Submissions)
*治験:Pre-Market reports (IND and IND-exempt BA/BE)
市販後:Post-Marketed reports (Combination Product and Non combination product)
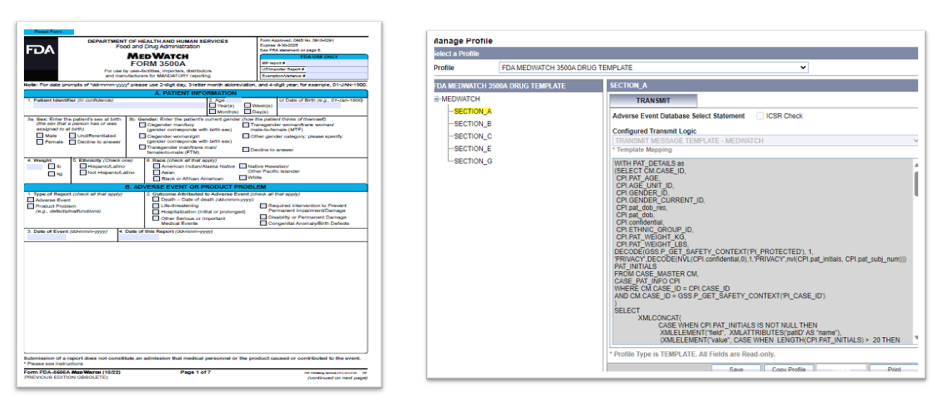
・FDA MedWatch 3500A (医薬品)対応
(各種E2B Profileと同様に)MedWatch用のProfileを用意しました。
これにより、項目毎の出力ロジックをArgus Console画面より変更することが可能になりました。
≪その他≫
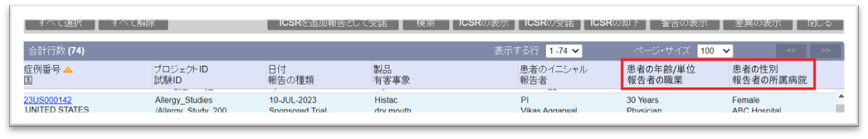
・重複検索結果画面での表示項目を追加しました。重複検索結果の確認時に利用可能です。
詳しくは、What’s New(HTML/ Video)をご確認下さい。
Argus 8.4.2についてご興味・ご関心を持っていただけましたら、ぜひ以下のメールアドレスまでお問合せ下さい。
hsgbu-oracle_jp@oracle.com
最後までお読みいただき有難うございました。
